Treg(Regulatory T Cell:制御性T細胞)とは
-
Tregの概要
制御性T細胞(Treg)は、RegCell社の技術顧問である坂口志文教授により発見されたT細胞です。Tregは、CD4 T細胞中の抑制性細胞集団で、核内にマスターコントロール遺伝子Foxp3 (forkhead box protein P3) 、細胞表面に高親和性インターロイキン2受容体のα鎖 (IL-2Rα or CD25) を発現することにより定義されます。Tregは、ヒトの血中CD4 T細胞の約10%を占めており、免疫自己寛容と恒常性の維持に関与し、自己免疫疾患、アレルギー、炎症性腸疾患を予防するとともに、臓器移植における移植片拒絶反応や造血幹細胞移植後の移植片対宿主病の予防に効果が期待されています。Tregは、CD4+およびCD8+T細胞、B細胞、樹状細胞、マクロファージ、マスト細胞、ナチュラルキラーT細胞などの多様な免疫細胞集団に対して、細胞接触、さらにIL-10 (インターロイキン10)などの免疫抑制サイトカインを分泌し免疫抑制活性を発揮します。
-
自己免疫疾患におけるTreg
自己免疫疾患やその他の免疫疾患の原因としてのTreg異常の典型例は、Foxp3遺伝子変異によって発症する、Immune dysregulation, polyendocrinopathy, enteropathy, X-linked (IPEX) syndromeと呼ばれる遺伝疾患です。1型糖尿病などの自己免疫疾患、食物アレルギーを含む重篤なアレルギー、炎症性腸疾患などを発症します。CD25やCTLA4など、Tregの発生や機能に影響を与え、Foxp3変異と同様の免疫疾患を引き起こす遺伝子は多数報告されており、これらの異常による免疫疾患は現在Tregopathy (制御性T細胞疾患)と呼ばれています。このような単一遺伝子性自己免疫疾患に加えて、Treg特異的遺伝子座の一塩基多型(SNPs)は、Tregの発生や機能に影響を与え、関節リウマチなどの多遺伝子性自己免疫疾患の発症に関係しています。従って、Tregを標的とした治療法は、様々な自己免疫疾患に対する有効な治療法として期待されています。
-
Tregの可能性
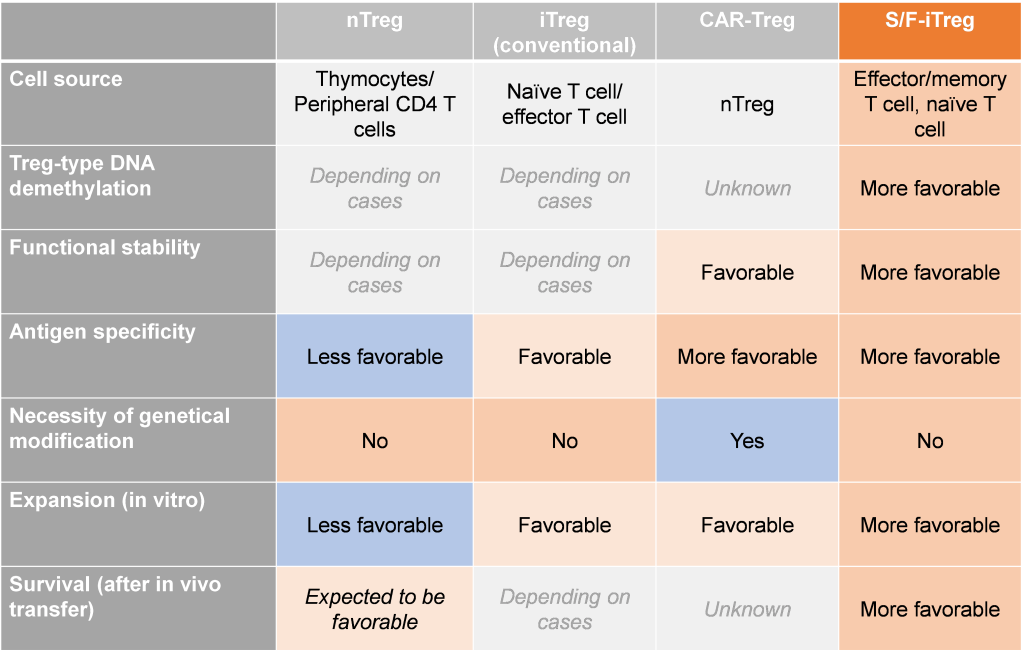
Tregによる細胞治療には、内在性Treg(nTreg)、誘導型Treg(iTreg)、キメラ抗原受容体(CAR)-Tregが用いられます。
nTreg
現在のnTreg細胞療法は、患者の血液から採取し体外で増殖させた自家nTreg細胞を利用しています。Foxp3-low、CD25-intermediate、CD45RA-highの表現型を持つナイーブnTreg細胞を、抗CD3抗体および抗CD28抗体のポリクローナル刺激により増殖させます。このようなポリクローナルTreg細胞は、少なくとも1年間はレシピエントの体内で検出できることが証明されており、T1DまたはGVHDの患者に対する自家nTreg移植の第1相試験で、実行可能性、安全性がすでに証明されていますが、一方でnTregに関して以下の課題が指摘されています。
1)試験管内で増殖抵抗性を示す。
2)治療に十分な細胞数を増やすことが困難である。
3)抗原特異性が保証できない。
4)自己免疫疾患患者ではTreg機能が異常な場合がある。
5)整体に移入後の動態が不明である。
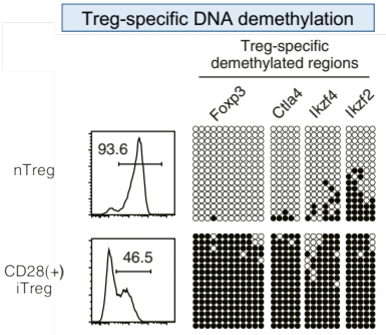
6)生体内での生存期間が確定されていない。iTreg
試験管内で、TGF−βによって誘導された従来のiTreg細胞は、Treg型のDNA脱メチル化を示さず、FoxP3や他のTreg特異的遺伝子の発現が不安定であり、従って機能的に不安定で、生体内移入後にエフェクターT細胞に転換する可能性があります。CAR-Treg
養子免疫療法にnTreg細胞を使用する際の課題は、nTreg細胞がヒト血液中に比較的少ないことと、in vitroでの増殖速度が遅いことにより、精製と増殖が制限されることにあります。これらの問題を回避するための一つの解決策が、特定の標的自己抗原に特異的な抗体のFab領域を発現させることによって抗原特異性を付与し、nTreg細胞からCAR-Treg細胞を作製することです。このような単一抗原に特異的なCAR-Treg細胞は、その活性化がペプチド/クラスII MHCのTCR認識に依存しないため、バイスタンダーサプレッションにより自己免疫反応を強く抑制すると考えられます。また、自己免疫患者の後々の治療のため、一旦作製したCAR-Treg細胞を保存することも可能です。一方、一般的には2つの課題があると言われています。
1)不特定または複数の抗原に対する免疫を抑制できない。
2)遺伝子組換えによる安全性が懸念される。
当社の技術
-
新しい価値の提供
S/F-iTreg は、nTreg、従来の iTregs、CAR-Treg の問題点を解決しました。S/F-iTregの技術を“自家”細胞治療に応用することで、未知の抗原に起因するアンメットメディカルニーズの高い多くの自己免疫疾患や、抗原は既知であるが治療法のない自己免疫病に対しても、免疫系全体を抑制することなく抗原特異的な免疫抑制が可能です。この治療法は、T細胞が認識する抗原を特定し、抗原特異的治療法を開発するという従来のアプローチとは全く異なる方法に基づいています。この免疫抑制技術は様々な自己免疫疾患に応用できるため、私たちの治療コンセプトが実証されれば、様々な自己免疫疾患の治療に道を開くことになります。また、自己細胞由来で遺伝子導入や改変を必要としないため、副作用のない安全な治療法として、患者負担を軽減し、QOLの向上に寄与すると期待されます。
(出典) Modified from a figure in “Preparation of natural or induced Treg cells for treating autoimmune diseases Mikami, Kawakami and Sakaguchi 37, Curr Opin Immunol, 2020 67:36-41”
-
独自の技術
私達の開発した一連の技術では、メモリー/エフェクターT細胞やナイーブT細胞を含む末梢血リンパ球から、Foxp3などのTreg特異的遺伝子を高発現するのみならず、Treg特異的なDNA脱メチル化を示すとともに、特定の自己抗原を認識するTCRを発現する機能的に安定なiTregを高効率で作製できます。本技術は、次世代型iTregであるS/F-iTreg ” ImmuTact®”を作製すべく、安定性と機能性を最大限に高めるように最適化しています。また、GMP準拠の設備において、臨床スケールでのS/F-iTregsの作製が可能であることを確認済みです。(関連特許を出願中)
-
培地・試薬
CDK8/19キナーゼ阻害剤
サイクリン依存性キナーゼ8(CDK8)およびCDK19の阻害により、ナイーブCD4+/CD8+ T細胞と同様に、抗原刺激を受けたエフェクター/メモリー細胞にFoxp3を誘導できます。この誘導は、STAT5の活性化に関連し、TGF-β作用とは無関係で炎症性サイトカインの影響を受けません。CDK8/19は、生理的に、活性化T細胞におけるFoxp3発現を抑制していますが、その薬理学的阻害により、抗原特異的エフェクター/メモリーT細胞のFoxp3+ Treg細胞への変換が可能となります。様々な免疫疾患の治療への応用が期待できます。当社オリジナル培地 “TrSM™”
GMPグレードのTrSM培地は、iTregの誘導、nTregと同様の増殖、炎症性サイトカインの放出抑制、T細胞の活性化抑制に高度に最適化されています。 -
誘導プロセス
既存のiTregの作製においては、CD4+ナイーブT細胞を、ヒトIL-2とヒトTGF-βの存在下、プレート結合抗CD3 mAbで刺激します。一方、S/F-iTregの作製では、Treg特異的エピゲノム安定化のためのCD28刺激の除去、より高いFoxp3誘導のためのCDK8/19阻害剤の添加、PBMCからの単球除去などにより、高機能化を付与するための様々なノウハウが組み合わされています。詳細は、Mikami et al., PNAS 117(22), 12258-68, 2020を参照。
-
効果
S/F-iTreg は、Treg 特有の DNA脱メチル化を安定的に獲得し、生体に移植後もFoxp3 を安定的に発現し、生存期間が長く、これら全ての結果、抗原特異的免疫応答を効果的に抑制できます。
S/F-iTregsの安定性と機能性はnTregsと同等であり、nTregの試験管内での増殖抵抗性を克服しています。試験管内での抗原特異的免疫抑制活性、生体での治療効果を示唆するデータが取得されています。また、治療後の効果持続の指標となる感染性免疫寛容の誘導も確認されています。
対象疾患
-
(A) 自己免疫疾患
自己免疫疾患は、慢性に進行し死亡率も高い疾患です。自己免疫疾患の主な病因は完全には解明されていませんが、免疫寛容の破綻が自己免疫疾患の共通の原因であると考えられています。自己免疫疾患患者におけるTregの関与が証明され、Tregを用いた細胞療法が自己免疫疾患の新たな治療法の選択肢として期待されています。
-
(B) 炎症性疾患
非開示
-
(C) 移植拒絶反応
臓器移植(膵島細胞、肝臓、腎臓など)は、末期臓器不全に対する標準治療法です。臓器移植の成績はここ数十年で改善されてきていますが、慢性拒絶反応と免疫抑制剤の副作用は依然として深刻な問題です。現在の免疫抑制剤では、抗原特異的に免疫抑制することができず、免疫抑制剤の長期投与による副作用を避けることができません。Tregは移植免疫寛容の抗原特異的誘導、安全な免疫制御ための有望な解決策になると期待されています。